Cannabis como PANC, e suas aplicações alimentícias e nutricionais
Por Agatha Cardoso | 20 de abril de 2023
Esse conteúdo faz parte da série “Cannabis: Conhecimentos Científicos made in Brazil”, em que o site Green Science Times reproduzirá artigos técnicos e científicos, produzidos por especialistas que compõem o Grupo de Trabalho Farmacêutico da Associação Brasileira das Indústrias de Cannabis (ABICANN).
Nos créditos, acima e no final da página, será possível que você conheça um pouco mais sobre os perfis destas e destes profissionais, que contribuem para orientação de interessados em pesquisas, ciências, saúde e inovações com a planta Cannabis sativa. Acompanhe o artigo desta edição:
Aspectos Nutricionais da Cannabis
Autores: Raissa Sansoni do Nascimento e Lucas de Freitas Pedrosa.
Coordenação: Fábio de Oliveira Costa Junior.
A Cannabis sativa L., comumente conhecida como cânhamo é uma planta herbácea da família Cannabaceae. Cultivada há centenas de anos e considerada uma planta polivalente pode ser utilizada com diversos propósitos, tais como: produção têxtil, construção civil, produção de papel, adubo, cosméticos, biocombustíveis, alimentos, produtos veterinários, uso recreativo e para fins medicinais.
Existem mais de 100 tipos diferentes de fitocanabinóides identificados na Cannabis. Entre eles, o THC (delta-9- tetrahidrocanabinol) e o CBD (canabidiol) são os dois compostos principais e mais estudados (Adesina et al., 2020). O CBD é o principal canabinóide do cânhamo industrial e se difere do THC (encontrado principalmente na maconha) por não conferir propriedades psicoativas (Shen et al., 2021).
As variedades de C. sativa L. que foram permitidas para cultivo contêm um nível de delta-9-tetrahidrocanabinol (THC) inferior a 0,3% ou 0,2% da parte reprodutiva da planta feminina na floração e são chamadas de “cânhamo industrial” ou cânhamo “tipo fibra”. As plantas cultivadas para fins recreativos são caracterizadas pelo alto nível de THC e as cultivadas para fins medicinais altos níveis de THC e/ou CDB (no Brasil são permitidos apenas produtos com baixo teor de THC, menos de 0,2%).
A origem da palavra “maconha” ocorreu por meio de anagrama “cânhamo” que consiste na alteração da ordem das letras para formar outra (Carlini, 2006). O cânhamo e a maconha são a mesma espécie de planta – Cannabis sativa, mas a diferença está na sua composição química, produção e usos. Cânhamo é qualquer linhagem de Cannabis sativa que contenha menos de 0,3% de THC (o principal composto psicoativo da planta) e a maconha (Cannabis sativa ou Cannabis indica) é qualquer linhagem de cannabis com mais de 0,3% de THC por peso seco. A utilização de produtos apenas com CDB tem uma aceitação maior em relação à produtos com os demais canabinoides, isso por conta de seu baixo teor tóxico. Produtos provenientes do cânhamo industrial, ricos em CDB, já estão regulamentados em vários países. A Agência Nacional de Vigilância Sanitária dos EUA (FDA – Food and Drug Administration) incluiu o cânhamo para uso em produtos para o corpo, cosméticos, suplementos nutricionais e produtos terapêuticos.
A semente do cânhamo tem despertado um interesse crescente nas últimas décadas por conta de seu alto valor nutricional, facilidade de digestão e de seus benefícios à saúde. A composição química das sementes pode variar amplamente entre os cultivares, mas elas são ricas em fitosteróis, vitaminas, minerais, ácidos graxos (ômega-6 e ômega-3), proteínas com alto valor biológico (de 20-25%, principalmente albumina e globulina) e em aminoácidos essenciais (HOUSE et al., 2010). Embora a composição dos aminoácidos provenientes de proteínas vegetais seja dependente de vários fatores, como genótipos e condições agronômicas (como por exemplo, fertilidade do solo e processamento pós-colheita), a proteína do cânhamo representa uma fonte valiosa de aminoácidos, pois contém todos os aminoácidos essenciais (Hadnadev et al., 2018; Russo & Reggiani, 2015; Shen, Gao, Xu, Ohm, et al., 2020). Além disso, as sementes possuem uma grande quantidade de óleo (de 25% a 35% da semente inteira) e de fibra insolúvel, podendo serem consumidas como sementes inteiras ou descascadas, bem como processadas na forma de óleo, farinha ou proteína em pó (VONAPARTES et al.,2014). Atualmente as sementes são utilizadas em uma variedade de produtos alimentícios e suplementos com altas propriedades nutricionais.
Tabela 1. Composição nutricional das sementes de cânhamo. Adaptado do livro “The Industrial Hemp Industry; Food for Thought: Perceptions & Attitudes of Key Participants within the New Zealand & Australian Hemp Industry”; (EIHA, 2013).
| Composição nutricional das sementes descascadas de cânhamo em 100 g | |
| Calorias | 580 Kcal |
| Gordura Totais | 45 g |
| Proteínas | 35 g |
| Carboidratos | 8 g (fibra 6 g) |
| Cinzas | 6 g |
| Minerais e vitaminas selecionados (em porcentagem de valor diário) | |
| Fósforo | 130 % |
| Magnésio | 150 % |
| Manganês | 450 % |
| Ferro | 90 % |
| Zinco | 60 % |
| Vitamina B1 (tiamina) | 90 % |
| Vitamina B3 (niacina) | 30 % |
| Vitamina B5 (ác. pantotênico) | 90 % |
| Vitamina E (tocoferol) | 20 % |
| Composição de ácidos graxos do óleo de cânhamo | |
| Ácidos Graxos Insaturados 90 % | |
| Ácido oleico (18:1 ômega-9) | 10 – 15 % |
| Ácido Linoleico (18:2 ômega-6) | 55 – 60 % |
| Ácido Alfa Linolênico (18:3 ômega-3) | 17 – 20 % |
| Ácido Gama Linolênico (18:3 ômega-6) | 2 – 4 % |
| Ácido Estearidônico | 0,5 – 2 % |
| Ácidos Graxos Saturados 10% |
O óleo da semente de cânhamo contém ácido linoleico (LA) e ácido α-linolênico (ALA) como seus principais ácidos graxos poliinsaturados ômega 3 e ômega 6 respectivamente. Os ácidos graxos LA e ALA estão presentes em uma proporção nutricional ideal de 3:1 (LA para ALA) conferindo uma série de várias qualidades benéficas como ação anticancerígena, anti-inflamatória, antitrombótica e aumento da taxa metabólica (Simopoulos, 1994; Callaway, Tennila & Pate, 1996; Leizer et al., 2000).
Existem outros constituintes no óleo da semente de cânhamo, além dos ácidos graxos, que também apresentam propriedades benéficas ao estado nutricional, como por exemplo o sitosterol e o tocoferol. Embora a maioria dos estudos tenha demonstrado principalmente a eficácia do sitosterol na redução da hipercolesterolemia, este componente também possui propriedades antivirais, antifúngicas e anti-inflamatórias (Malini & Vanithakumari, 1990). Os esteroides vegetais são conhecidos por diminuírem os níveis de colesterol através do bloqueio da sua absorção por cristalização e coprecipitação (Mattson et al., 1982) e pela competição na absorção entre os esteróis e o colesterol na mucosa intestinal (Lees et al; 1977).
O óleo da semente de cânhamo possui quantidades significativas de tocoferol, componente com propriedades antioxidantes exploradas há algum tempo. Mas a atividade mais interessante do tocoferol, que ainda não foi amplamente estudada, seja sua capacidade de atuar como agente anticancerígeno, especificamente no que diz respeito ao câncer de cólon. Como o tocoferol é secretado através da bile no intestino e no material fecal, ele pode inibir a peroxidação lipídica e reduzir a formação de produtos mutagênicos no intestino (Stone & Papas, 1997; Leizer et al., 2000).
Tabela 2. Composição química média dos produtos da semente do cânhamo. Adaptado de House et al., 2010 e Leonard et al., 2020.
| Fração de sementes | Matéria seca | Gordura bruta | Proteína bruta | Fibra dietética | Cinzas |
| Semente inteira | 94,1 ± 2,0 | 30,4 ± 2,7 | 24,0 ± 2,1 | 32,1 ± 2,5 | 4,8 ± 0,7 |
| Semente descascada | 95,1 ± 1,4 | 46,7 ± 5,0 | 35,9 ± 3,6 | 7,8 ± 5,1 | 6,4 ± 0,8 |
| Farinha de semente | 95,1 ± 2,3 | 10,2 ± 2,2 | 40,7 ± 8,8 | 30,5 ± 8,8 | 6,7 ± 1,0 |
| Casca de cânhamo | 94,9 ± 1,8 | 10,3 ± 5,8 | 12,7 ± 3,7 | 64,9 ± 9,3 | 3,9 ± 0,6 |
Tabela 3. Comparativo entre os teores proteicos. Adaptado do livro “Os benefícios surpreendentes da semente de cânhamo: por que você deve cultivar suas próprias sementes de cânhamo orgânicas”, (Anthony J. Rushford, 2016).
| Alimentos de origem vegetal | Porcentagem (%) |
| Soja | 35 |
| Semente de cânhamo descascada | 31 |
| Semente de cânhamo inteira | 23 |
| Amêndoas | 18 |
| Farinha de trigo | 13 |
| Tofu | 8 |
| Alimentos de origem animal | Porcentagem (%) |
| Carne de hambúrguer | 27 |
| Frango | 23 |
| Queijo Cheddar | 23 |
| Ovo | 12 |
| Leite desnatado | 4 |
Tabela 4. Aminoácidos Essenciais comparados. Adaptado do livro “Os benefícios surpreendentes da semente de cânhamo: por que você deve cultivar suas próprias sementes de cânhamo orgânicas”, (Anthony J. Rushford, 2016).
| Aminoácido Essencial | Semente de cânhamo | Ovos Brancos | Tofu | Leite de vaca |
| Leucina | 18,80 | 9,50 | 5,9 | 3,44 |
| Lisina | 9,10 | 6,48 | 5,7 | 2,72 |
| Treonina | 10,30 | 4,77 | 3,7 | 1,61 |
| Fenilalanina+Tirosina | 21,90 | 6,89 | 4,8 | 1,70 |
| Valina | 14,20 | 8,42 | 4,3 | 2,40 |
| Metionina+Cistina | 9,60 | 4,20 | 1,0 | 0,86 |
| Isoleucina | 11,40 | 6,98 | 4,1 | 2,23 |
| Triptofano | 3,90 | 1,64 | 1,2 | 0,49 |
Como podemos observar pelas informações contidas na tabelas acima, um quil de semente de cânhamo forneceria todas as proteínas, ácidos graxos essenciais e fibras alimentares necessárias para a sobrevivência humana por duas semanas.
Além de seu alto valor nutricional, a semente de cânhamo também se caracteriza pela presença de diversos compostos bioativos, dentre os quais se destacam os fenólicos e peptídeos bioativos com atividades antioxidante, anti-inflamatória, neuro protetora, anti-hipertensiva, antiproliferativa e hipocolesterolêmica, avaliadas principalmente por estudos in vitro (Leonard et al., 2020; Shen et al., 2021). Do lado negativo podemos citar a detecção de vários fatores antinutricionais nas sementes de cânhamo, incluindo inibidor de tripsina, ácido fítico, glicosídeos cianogênicos, taninos condensados e saponinas (Poji´c et al., 2014; Russo & Reggiani, 2015). A utilização de proteínas vegetais em alimentos pode ser limitada pelos fatores antinutricionais, pois estes podem influenciar negativamente a digestibilidade e as propriedades organolépticas, bem como a biodisponibilidade de outros nutrientes (Poji´c et al., 2014).
20.2 Porque é uma PANC- Planta Alimentícia Não Convencional
O termo PANC foi criado em 2008 pelo biólogo Valdely Ferreira Kinupp e referese a todas as plantas que possuem uma ou mais partes comestíveis, sendo elas espontâneas ou cultivadas, nativas ou exóticas que não estão incluídas em nosso cardápio cotidiano. É importante destacar que as PANCs podem ser consumidas rotineiramente em algumas regiões, por isso não são consideradas não convencionais nesses locais (Kelen et al.,2015). As plantas caracterizadas como PANCs ainda não foram completamente estudadas por parte da comunidade científica e/ou exploradas pela sociedade como um todo, resultando em consumo regional e apresentando dificuldade de aceitação e consumo para as demais regiões do país (BRASIL, 2010).
A cannabis é uma PANC (Planta Alimentícia Não Convencional) e todas as suas partes, sementes, raízes, caules, folhas e flores são comestíveis e ricas em nutrientes, porém a principal fonte de canabinoides é a planta fêmea. As sementes do cânhamo não contêm naturalmente THC ou CBD e são um alimento promissor para o mercado de nutrição.
Os produtos comestíveis e as preparações culinárias à base de maconha tornaram-se um mercado promissor e de grande procura. Apesar de no Brasil não ser legalizada, a maconha é encontrada em preparações orais comercializadas ilegalmente no país e a busca por esses produtos tem crescido nos últimos anos. Produtos alimentícios com extratos de Cannabis surgiram como um mercado lucrativo em países onde o uso de maconha foi legalizado (White et al., 2020). No entanto deve ser dada uma atenção especial ao se consumir comestíveis com extratos de Cannabis, pois estes podem ser tão ou mais perigosos quanto outras formas de consumo (Leventhal et al., 2020). Nesse sentido, o maior problema é a lacuna de conhecimento que existe sobre os efeitos sistêmicos do consumo por via oral (Farmer et al., 2019).
As preparações comestíveis de cannabis podem resultar em riscos maiores que as preparações inaláveis devido à lenta taxa de absorção do THC ingerido por via oral. O THC é encontrado em todas as partes da planta, mas principalmente nas flores e resina das plantas fêmeas (10-12 % nas flores, 1-2% nas folhas, 0,1- 0,3 % nos caules, até 0,03% nas raízes) (Aguiar, 2016). O pico do nível sanguíneo do THC inalado e os efeitos da droga são alcançados em cerca de 30 minutos, diferindo dos comestíveis, que são alcançados em aproximadamente 3 horas. Isto torna mais difícil para os usuários de cannabis comestível titular as doses necessárias para atingir os efeitos desejados da droga, além do que a depuração mais lenta do THC oral pode levar ao acúmulo da droga se os usuários tomarem doses adicionais quando não sentirem os efeitos desejados tão rapidamente quanto esperado (Volkow & Ruben, 2019).
Os efeitos gerais da cannabis comestível podem ser divididos em efeitos subjetivos positivos, como sentimentos agradáveis, felicidade, relaxamento, energia, aumento do desejo sexual, criatividade, social, e efeitos negativos, como dificuldade de concentração, ansiedade, sonolência, vertigem, perda de controle, preguiça e sintomas gastrointestinais. Além disso, há o fator de gravidade que pode trazer riscos à saúde, como condução prejudicada e transtornos psiquiátricos (Boisvert et al., 2020). O THC (tetrahidrocanabinol) em altas doses pode causar psicose dose-dependente aguda e transitória com sintomas positivos e negativos da esquizofrenia, como também pode aumentar o risco de desenvolver esquizofrenia propriamente dita em até duas vezes (Volkowet al., 2016).
Embora os efeitos negativos da cannabis sejam bem conhecidos para algumas condições, como a exacerbação da psicose associada ao THC, outros provavelmente surgirão à medida que mais pacientes forem expostos à cannabis, como interações medicamentosas negativas, ao exemplo do aumento mediado pelo THC no tempo de sangramento em pacientes em uso de varfarina (Volkow & Ruben, 2019).
É importante destacar que o procedimento de aquecimento é necessário para a descarboxilação do Tetra-hidrocanabinol (THC), e, portanto, para a ativação de canabinoides e terpenos através do calor (Barrus et al., 2016). A cannabis é lipossolúvel e após a descarboxilação os canabinoides podem ser extraídos da planta e diluídos em infusão de gordura ou álcool para serem utilizados na comida. Os alimentos de cannabis que contém canabinoides, especialmente o THC são conhecidos como “edibles”, termo em inglês para comestíveis canábicos.
As preparações não psicoativas utilizam a flor crua, sem descarboxilação ou outras partes da planta que possuam alto valor nutricional sem a presença de canabinoides.
20.3 Potencial nutracêutico
Uma grande variedade de produtos alimentares a base de cannabis já é vendida diariamente em vários países da Europa, Ásia, Oceania e América do Norte. Na américa latina Uruguai, Equador e Colômbia adotaram uma regulamentação específica para o uso das sementes de cânhamo e CDB em alimentos. Já no Brasil os alimentos de cânhamo estão proibidos por força da Portaria nº 344/98, que trata sobre substâncias e medicamentos sujeitos a controle especial. De acordo com a portaria, uma vez que cânhamo é Cannabis sativa e esta se encontra inserida na “Lista E”, são proibidos “no Brasil seu comércio, importação, exportação, manipulação e o uso, assim como de todas as substâncias obtidas dessa planta”.
Derivados não psicoativos do cânhamo se tornaram extremamente populares para o uso em alimentos, bebidas e suplementos alimentares por conta do grande potencial nutricional e de seus benefícios à saúde, como: alívio do estresse, melhoria de humor e assim por diante. No entanto, o status regulatório do cânhamo e do CBD como ingrediente alimentar é um desenvolvimento recente em vários mercados ao redor do mundo. Em alguns casos, existem regulamentos e diretrizes específicas com condições claras de uso do CBD em alimentos e suplementos alimentares. Em outros casos, as avaliações de segurança ainda precisam ser realizadas antes que os produtos que contenham ingredientes de CBD possam ser comercializados legalmente. As preocupações com o CBD como ingrediente estão relacionadas à segurança alimentar e à saúde pública.
Recentemente a União Europeia limitou os níveis de THC para os alimentos de cannabis. O novo regulamento estabelece que os níveis de THC para óleo derivado de sementes de cânhamo não devem exceder 7,5 mg/kg e em alimentos secos que contenham cânhamo (sementes, farinha e proteína em pó) não podem exceder 3 mg /kg.
A atual regulação do cânhamo no Brasil prejudica a indústria de alimentos e a torna dependente de outros países. A proibição do cultivo da cannabis e a falta de uma regulamentação específica limita o crescimento econômico nesse setor. Para se comercializar alimentos industrializados no pais é necessária uma solicitação junto a Anvisa, conforme estabelecido no Anexo II da RDC nº 27/2010). Novos alimentos e novos ingredientes seguem a Resolução nº 16/1999 e Resolução nº 17/1999 e alimentos com alegações de propriedades funcionais e/ou de saúde Resolução nº 18/1999 e Resolução nº 19/1999.

https://twitter.com/CannabisHubHQ/status/1477266351811178497
O uso alimentar da cannabis responde por 7,29% de todos os usos no banco de dados global do CANNUSE (Um banco de dados de usos tradicionais da Cannabis), com 58,72% deles correspondendo a refeições tradicionais e 41,28% a bebidas tradicionais. As sementes (43,60%) são a parte vegetal mais utilizada para fins alimentares, pois oferecem abundante proteína de fácil digestão e forragem nutricional, elas ainda são consideradas uma excelente fonte de alimento para idosos em toda a Ásia (Iftikhar et al.,2021).
O cânhamo é considerado uma fonte alimentar de baixa alergênica, pois induz apenas certos sintomas leves (Decuyper et al., 2017). Até agora, cinco alérgenos putativos mais relevantes foram identificados em diferentes partes do cultivo de cânhamo (Cannabis sativa), como raízes e folhas; estes são ribulose-1, 5- bifosfato carboxilase/oxigenase (RuBisCo), proteína semelhante à taumatina, proteína intensificadora de evolução de oxigênio, profilina e Can s 3 (Decuyper et al., 2017).
Podemos observar nos últimos anos uma tendência crescente no consumo de cânhamo ou produtos alimentares com proteínas de cânhamo como ingredientes funcionais, isso devido ao seu valor nutritivo, excelente digestibilidade e baixa alergenicidade. O leite de cânhamo, produzido a partir de sementes inteiras é capaz de promover benefícios para a saúde, como a redução do colesterol sérico, triacilglicerol e hormônios da tireoide. Além disso, por ser isento de lactose e hipoalergênico, o leite de cânhamo pode ser uma alternativa atraente a leites lácteos, de soja e castanhas (Wang, Jiang e Xiong, 2018). Bebidas fermentadas de cânhamo mostraram forte atividade prebiótica, estimulando o crescimento de bactérias benéficas e a quantidade de certos compostos bioativos (Nissen et al., 2020).
O pão suplementado com farinha de cânhamo (>10%) garante maior valor nutricional sem sacrificar a estabilidade e a massa (Poji´c et al., 2015). Além disso, a proteína do cânhamo é superior à da soja como ingrediente funcional na produção de massas de pão, pois apresenta propriedades mais próximas às de uma massa de trigo e produz pães com maior qualidade e aceitação com relação ao sabor e cor (Baldino et al., 2020).

A ascensão do CBD como ingrediente alimentar está apenas começando a emergir da sombra da proibição da cannabis, apresentando um desafio legal para os produtores de alimentos que desejam adicioná-lo aos seus produtos.
Hoje existe uma gama de produtos com infusão de fitocanabinóides em líquidos, como leites, chás, cafés, bebidas à base de frutas cítricas e águas engarrafadas aromatizadas ou oxigenadas (king et al., 2019).
A partir disso, pode se notar o crescente interesse da indústria na formulação e produção de novos produtos com ingredientes funcionais à base cannabis.
20.4 Suplementos alimentares de cannabis
A indústria de alimentos de cannabis sativa será uma combinação das indústrias alimentícia e farmacêutica. O uso do cânhamo no setor de alimentos e suplementos está previsto para expandir nos próximos anos à medida que a demanda cresce, com enormes implicações sociais, econômicas e sanitárias.
Os suplementos alimentares são gêneros alimentícios que constituem fontes concentradas de nutrientes ou outras substâncias com efeito nutricional ou fisiológico. Destinam-se a complementar ou suplementar uma dieta normal e podem ser usados para corrigir carências nutricionais ou manter uma ingestão adequada de certos ingredientes e devem ser consumidos de acordo com uma dose máxima recomendada.
O cânhamo e seus derivados podem ser usados como nutracêuticos ou como ingredientes alimentares enriquecidos em nutrientes e compostos bioativos não nutrientes. Como a Cannabis possui uma composição particular rica em nutrientes e compostos bioativos, a exploração desta planta na nutrição humana é uma linha de pesquisa prioritária em nível global (Martinez et al., 2020).
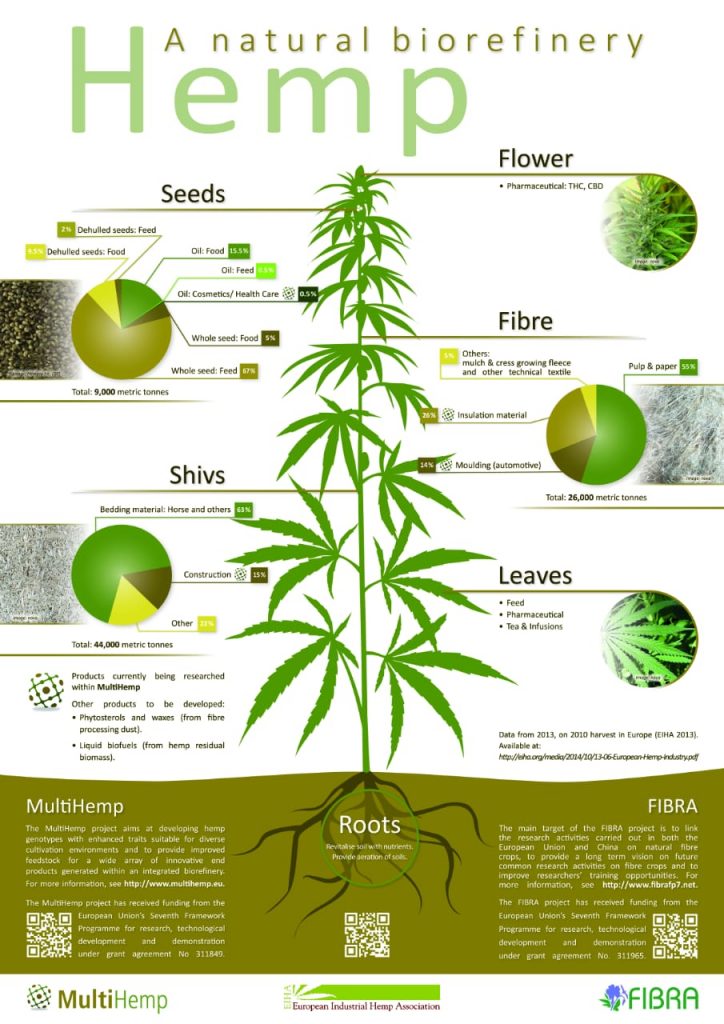
Estudos realizados com a planta cannabis permitiram a identificação de centenas de compostos diferentes com atividade biológica em potencial, incluindo mais de 120 terpenoides, 100 canabinoides, 50 hidrocarbonetos, 34 compostos glicosídicos, 27 compostos nitrogenados, 25 fenóis não canabinoides, 22 ácidos graxos, 21 ácidos simples, 18 aminoácidos, 13 cetonas simples, 13 ésteres e lactonas simples, 12 aldeídos simples, 11 proteínas, proteínas glicosiladas e enzimas, 7 álcoois simples, 11 esteróides, 9 oligoelementos, pigmentos e vitamina K (Cerino et al., 2021; Martínez et al., 2020). A Figura 6 mostra as diferentes partes anatômicas da planta de cânhamo e a presença de nutrientes e compostos bioativos em cada parte. As sementes de cânhamo foram estudadas extensivamente no passado, mas pouco se sabe sobre a composição e as características funcionais das outras partes anatômicas da planta de cânhamo (Martínez et al., 2020)

De acordo com as evidências científicas, a cannabis e os canabinóides têm uma ampla gama de efeitos biológicos, incluindo controle da dor crônica em adultos, antieméticos em náuseas e vômitos induzidos por quimioterapia e diminuição dos sintomas de espasticidade de EM relatados pelo paciente. Várias investigações descobriram que eles têm vantagens adicionais para a saúde, particularmente como agentes terapêuticos. A maioria dos estudos sobre os benefícios para a saúde do cânhamo industrial foi feito em uma fase pré-clínica (Rupasinghe et al., 2020).
O CDB é atualmente comercializado como suplemento dietético derivado principalmente do cânhamo, sujeito à legislação e ações regulatórias em evolução, e como medicamento. Apesar do grande consumo de CDB como suplemento nutricional, evidências de estudos clínicos explorando os efeitos do CDB como ingrediente alimentar ainda são escassas. O canabidiol tem potencial para induzir toxicidade hepática quando administrado em doses farmacológicas. Em alguns ensaios realizados com o medicamento Epidiolex foram observadas as seguintes reações adversas: sonolência, sedação, diminuição do apetite, fadiga, diarreia, elevação das transaminases, erupções cutâneas e infecções. Tendo em vista a variedade de eventos adversos, além de potenciais interações relatadas com o uso do CDB em doses farmacológicas o FDA proibiu a comercialização do CDB como ingrediente para suplemento nutricional. A importância da questão do CDB sob o ponto de vista da saúde pública, reside na sua autoadministração sem supervisão médica e ampla disponibilidade como suplemento (Cerino et al., 2021).
Mesmo com tantos benefícios, a planta também apresenta suas características tóxicas, podendo ocasionar efeitos indesejáveis e risco a saúde do indivíduo, com isso recomenda-se a busca de um profissional capacitado para apresentar a melhor forma de se ingerir qualquer substância de origem da Cannabis sativa (Celestino et al., 2021).
A dose segura de CDB para ser consumido com segurança como suplemento nutricional é de 1-2mg/kg, de acordo com a Associação Europeia de cânhamo Industrial (EIHA). Já o medicamento Epidiolex, aprovado pelo FDA e indicado para o tratamento de convulsões associadas à Síndrome de Lennox-Gastaut ou síndrome de Dravet em pessoas com mais de 2 anos de idade, recomenda em bula a dosagem inicial de 2,5 mg/kg duas vezes ao dia (5 mg / kg por dia) e após uma semana de tratamento a dose pode ser aumentada para 10 mg/kg em duas tomadas.
20.5 Potencial de produtos de cannabis e cânhamo viáveis na indústria
A aplicação do cânhamo industrialmente vem de longa data, como no começo da dinastia imperial chinesa Han, expandindo-se então para a península coreana. Curiosamente a introdução da Cannabis no Japão atual pode ter sido no período tardio do paleolítico, cerca de 18.000 anos atrás, enquanto sua utilização como fibra começa no início do neolítico. Já sua utilização para tecelagem (com encordoamento / enovelamento), produção de roupas e cestas, marca a história do período Jōmon, onde o cânhamo pode ter participado também como parte de impressão em cerâmica, outra característica marcante do povo Jōmon (Clarke et Merlin, 2013).
Mundialmente, com a flexibilização e expansão de legislações referentes aos produtos baseados em Cannabis, estima-se um aumento considerável de empresas e companhias com esses focos de utilização industrial dos produtos derivados do cânhamo. A cadeia produtiva possível para a utilização de forma completa da planta de Cannabis, desde a sua raiz (para revitalização de solos de cultivo), passando pela fibra na indústria têxtil (utilizada historicamente, como citado no começo do capítulo) e sementes, finalizando na obtenção de óleos cosméticos/inseticidas/farmacológicos nas folhas e flores, torna seu cultivo um importante foco de atenção industrial e de otimização de produção, aproveitamento e aumento de valor (FARINON et al., 2020). Alguns exemplos de produtos estão descritos na tabela 5 a seguir.
Tabela 5. Produtos que já foram ou ainda são comercializados, partes da planta utilizados na composição, suas finalidades de aplicação e marcas.
| Produto | Parte da planta | Aplicação | Empresa |
| Bebidas | |||
| Cerveja com cânhamo | Sementes de cânhamo | Palatabilidade | New Belgium Brewing |
| Cerveja sem álcool | Talos, caules e raízes | Palatabilidade | Province Brands |
| Cerveja Two Flowers | CBD | Palatabilidade | Coalition Brewing |
| Xylem cider | Terpenos | Palatabilidade | Xylem cider works |
| General Washington’s Secret Stash | CBD | Palatabilidade | Dad & Dude’s Breweria |
| Produtos nutricionais | |||
| Óleo de CBD de amplo espectro | Sementes, raízes, folhas, inflorescências | Suplemento nutricional | FAB CBD |
| Óleo de CBD+CBG | Extrato de cânhamo | Suplemento nutricional | FAB CBD |
| Gomas com extrato de CBD | Isolado de CBD | Suplemento nutricional | FAB CBD |
| Óleo de semente de cânhamo | Sementes de cânhamo | Culinária/Nutricional | Midlands Nutrition |
| Sementes descascadas de cânhamo | Sementes de cânhamo | Culinária/Nutricional | Midlands Nutrition |
| Proteína isolada da semente de cânhamo | Sementes de cânhamo | Culinária/Nutricional | Midlands Nutrition |
| Farinha de fibra de semente de cânhamo | Sementes de cânhamo | Culinária/Nutricional | Midlands Nutrition |
| Farinha de semente de cânhamo sem remoção do óleo | Sementes de cânhamo | Culinária/Nutricional | Midlands Nutrition |
| Bolo de semente de cânhamo | Sementes de cânhamo | Culinária/Nutricional/ Alimentação animal | Bulk Hemp Warehouse |
| Produtos têxteis | |||
| Fibra de cânhamo | Talos, caules e raízes | Produção de tecidos e roupas | Ecological Textiles |
| Tricô de cânhamo | Talos, caules e raízes | Produção de tecidos e roupas | Ecological Textiles |
| Fibra não-tecido de cânhamo | Talos, caules e raízes | Produção de tecidos e roupas | Ecological Textiles |
| Fitas de cânhamo | Talos, caules e raízes | Produção de tecidos e roupas | Ecological Textiles |
| Fios de cânhamo | Talos, caules e raízes | Produção de tecidos e roupas | Ecological Textiles |
| Outros | |||
| Petiscos de cachorros com CBD | Extrato de óleo de cânhamo | Alimentação animal | CBDFx |
| Petiscos de cachorro com CBD | Extrato de óleo de cânhamo | Alimentação animal | FAB CBD |
| Petiscos de cachorro com CBD | Extrato de óleo de cânhamo | Alimentação animal | CBDistillery |
O óleo essencial, uma mistura de componentes voláteis e canabidiol extraída das folhas e inflorescências a partir dos processos de hidrodestilação ou destilação à vapor, partes estas que são descartadas em processos de produção das sementes e fibras, já possuem interesse potencial pela indústria farmacêutica (FIORINI e et al., 2019).
Na Europa, em diversos países, são utilizados cultivares monoicos e dioicos para essas finalidades comentadas acima, e outras como formação de biocombustível, todos respeitando a comissão de regulação Nº 206/2004 do parlamento europeu (EU, 2004), onde os cultivares contém menos de 0.2% do composto psicoativo Δ9 –tetrahidrocanabinol (THC). Os diferentes produtos (como Sativex®, Bediol® e Bedrocan®), medicamentos comercializados mundo a fora variam na sua razão THC: CBD. A ANVISA tem liberado comercialização de certos produtos de cunho medicinal com essa mesma restrição de 0.2% de quantidade de THC no Brasil, definidos junto a outras boas práticas de fabricação/importação na Resolução RDC Nº 327 de 9 de dezembro de 2019, como por exemplo os extratos apresentados na Resolução RE Nº 4.134 de outubro de 2021, sob receita médica do tipo B (azul).
Fiorini e colegas realizaram uma bateria de diferentes tratamentos das inflorescências, parte considerada residual do tratamento do cânhamo industrial, do cultivar Cannabis sativa cv. Felina 32 (total de 14 tratamentos diferentes) variando presença/tempo de secagem, temperatura, método de manipulação pré-destilação (moagem a 2mm ou cortes pequenos) e até assistência por microondas (com variadas exposições) (FIORINI et al., 2019). A ideia era a obtenção de um produto de óleo essencial concentrado em CBD, com o mínimo de THC, associado a um melhor nível dos compostos voláteis presentes na planta. Os tratamentos realizados através da hidrodestilação precedida por descarboxilação (pela alta temperatura) demonstraram maior eficácia no enriquecimento do óleo obtido com o CBD. Logo aqui podemos sugerir duas linhas principais de produtos que podem vir a ser interessantes em um contexto de larga escala atribuído a saúde: I) óleos puramente compostos por voláteis, com potencial pró-vitamínico (carotenoides e terpenoides), inseticida e antioxidante (terpenoides) e II) associação entre os compostos acima citados com os benefícios provenientes do CBD, ambos com ausência dos efeitos indesejados do THC.
As sementes também podem ser importante fonte de óleo essencial a ser extraído, e o método de extração tem atribuições de custo, melhora do rendimento e qualidade do extrato que podem variar significativamente. Devi e Khanam (2019) testaram diferentes métodos como extração supercrítica de fluídos (SFE), soxhlet, percloração, ultrasonicação, pirólise e a associação entre algumas delas. De um ponto de vista geral, a extração foi mais economicamente viável pelo método SFE, conservando uma maior qualidade e pureza de produto significante, seguido da extração com soxhlet e ultrasonicação. Em outros pontos de análise, a extração com soxhlet foi a que menos consumiu energia (61600 kW) e que teve a maior concentração de ácidos graxos identificados no óleo. A partir de outros estudos com temáticas semelhantes, pode-se estimar os melhores e mais eficazes métodos para exploração industrial de alta escala dos óleos essenciais de Cannabis no futuro próximo (DEVI e KHANAM, 2019).

Um estudo brasileiro recente demonstrou a manipulação de um óleo essencial de Cannabis sativa L. obtido comercialmente em nanoencapsulamento, demonstrando uma boa estabilidade das partículas geradas, sem separação de fase ou outros problemas de qualidade. O tratamento com essas partículas também foi mais eficaz quando comparado ao controle (óleo sem nanoencapsulamento). Esse acaba sendo outro foco importante de aplicação da tecnologia associado a uma matriz que pode ser explorada mais profundamente, seguindo sempre as legislações vigentes sobre os diferentes tipos de produção e seus produtos gerados (DE OLIVEIRA CARVALHO e colab., 2021).
Como brevemente citado anteriormente, o mesmo óleo essencial pode ser utilizado para fins medicinais/nutracêuticos, como para fins de pesticidas botânicos naturais. Essa potencial função vem a partir da secreção através dos pelos glandulares das folhas, onde o material é rico em sesquiterpenos e terpenos. A extração substancial de uma biomassa é feita nos resíduos de uso das partes da planta em outras indústrias, o que potencializa o valor comercial e o aspecto chamativo para os fazendeiros que estão de olho nas tendências verdes mundiais. Benelli e colaboradores (2018) extraíram o óleo essencial a partir das inflorescências da mesma cultivar citada acima, Cannabis sativa cv. Felina 32, obtendo um extrato interessante para servir como pesticida verde, principalmente contra pulgões e moscas (BENELLI e PAVELA e PETRELLI e colab., 2018). Os resultados encontrados estão de acordo com estudos prévios realizados pelo próprio grupo de pesquisa com outros cultivares (Felina 75) e despertam vasto interesse nesse sentido (BEDINI e colab., 2016; BENELLI e PAVELA e LUPIDI e colab., 2018).
20.6 Suplementação nutricional no esporte
A agência mundial anti-doping (WADA) retirou o composto canabinóide canabidiol da lista de substâncias banidas em 2018, enquanto outros da mesma classe como o THC continuaram proibidos. Mesmo com essa mudança, legislações locais variam drasticamente de país para país, e ainda a depender, como por exemplo os Estados Unidos, varia de estado para estado, tornando uma só posição mundial bastante improvável. Associado a isso, existe a necessidade de obtenção de produtos derivados de Cannabis com os compostos isolados, como nesse exemplo o CBD, sem contaminação por outros compostos canabinóides presentes na planta (mais de 140 compostos identificados), onde entram os pontos discutidos no capítulo anterior sobre melhora da eficácia do modelo industrial de extração das diferentes partes a serem exploradas comercialmente. As Olímpiadas de Tóquio (2021), por exemplo, já contaram com esse novo protocolo.
Ainda que a presença de outros canabinóides repercuta em uma sugestão de não-uso por corpos diretivos de certos times/esportes, por conta ainda do risco de doping e ultrapassagem de barreiras legais (principalmente conteúdo de THC nos produtos e consequentemente urina dos atletas, em casos de teste), estudos sugerem que o consumo de suplementos a base de CBD extraídos da cepa Cannabis sativa L. se encontra bem distribuído, por exemplo no estudo de Kasper e colaboradores (2020) onde atletas das ligas profissionais de Rugby do Reino Unido responderam um questionário anônimo sobre uso de CBD.
Dos 472 jogadores que disseram ter conhecimento sobre o CBD no meio, 339 relataram nunca ter usado CBD, principalmente por medo de violação de anti-doping (64%), seguido de não estarem cientes sobre os benefícios (37%), não sentir necessidade (29%) e os clubes alertando contra o uso (23%). O uso médio de CBD foi de 26%. Alguns times superaram a marca de 30% de seus jogadores com uso contínuo e atual na data da pesquisa, enquanto uma grande parte dos times restantes ficou na faixa de 15 a 25% de uso atual, mas o uso prévio/atual entre times acabou variando mais surpreendentemente entre 5 e 70%. Também naqueles que relataram o uso, a grande maioria revela que o uso é pela melhora na dor (80%) e sono (78%), em seguida com menor expressão pela ansiedade (32%) e outras indicações médicas (14%). De todos os atletas que relataram o uso, 14% de fato descreveram melhora em algum sintoma relacionado (KASPER e colab., 2020). Isso pode decorrer das doses variadas de consumo, o que será tratado mais adiante.
Uma revisão sistemática proposta por Docter e colaboradores (2020) também identificou em 11 estudos avaliados (n=46,202) uso de Cannabis em suas diferentes formas, reportado nos últimos 12 meses (para cada estudo), variando entre 2,5 e 62% e uso nos últimos 6 meses variando entre 5 a 19% e 11,2 e 32,7%). Esses largos intervalos são justificados pelos autores através da frequência onde os estudos avaliaram como consumo, desde uso único na vida até uso diário/semanal (DOCTER e colab., 2020). Embora os dados sejam interessantes de se observar, existem dois pontos a considerar: I) Todos os estudos analisados pela revisão são datados previamente ao cenário de retirada do CBD da lista de proibição da WADA, o que hoje pode se interpretar como uma desatualização dos dados, mas com importância de perspectiva histórica ainda; II) o consumo variava entre inalatório e comestível, mas não necessariamente de produtos à base de óleos contendo CBD apenas, o que não se compara ao cenário atual mais comum.
Burr e colaboradores (2021) também analisaram a literatura de uma forma extensiva. Primeiro, não houve diferenças entre usuários crônicos de Cannabis e não-usuários, sem exercício físico associado, em 4 diferentes estudos do tipo corte transversal, em fatores como VO2 máximo, pressão arterial, força muscular e medidas de resistência, capacidade de trabalho e cansaço percebido. Em dois desses estudos também não houve diferenças entre poder anaeróbico e marcadores de stress/inflamação. O consumo de Cannabis ou THC isolado teve efeitos altamente variados em uma série de estudos analisados pelos autores em relação a pressão arterial, indo até de mudanças significativas de pressões diastólicas e sistólicas até reduções, passando por efeitos nulos. À princípio, mudanças na pressão não seguem a tendência de mudança pós uso único de consumo da Cannabis, diferente do que foi observado na frequência cardíaca. Já o uso contínuo em altas doses de THC influiu em atenuação no aumento da pressão sistólica no exercício, e exagerada redução na pressão diastólica (BURR e colab., 2021).
Os autores também focaram os resultados encontrados acerca do uso de CBD exclusivamente. Para a melhora do sono por exemplo, eles reforçam a necessidade de estudos randomizados bem desenhados em população de atletas para conclusões seguras sobre os benefícios propostos, pois nesse contexto pode haver melhoras de sono e recuperação (BURR e colab., 2021). Em um estudo randomizado duplo cego em populações saudáveis (isto é, sem problemas de sono e outros), o uso de CBD em relativa dose alta (300 mg) de forma aguda não resultou em melhora dos parâmetros polissonográficos (LINARES e colab., 2018), o que reforça a necessidade do foco em atletas para melhores observações.
Dois modelos distintos de tratamento com CBD para problemas gastrointestinais inflamatórios foram avaliados por diferentes autores. No primeiro, uma dose baixa de CBD (10 mg 2 x ao dia) não foi capaz de aliviar sintomas e melhorar o quadro clínico de pacientes com doença de Crohn (NAFTALI e colab., 2017). Já no segundo, uma dose bem mais substancial (250 mg 2x ao dia) gerou uma melhora (validada, ainda que subjetiva) relatada por pacientes com colite ulcerativa, através de formulários conceituados sobre a percepção do estado da doença (IRVING e colab., 2018). Essa alta variabilidade de dose, porém, atrapalha em possíveis comparações mais profundas, e sugere a necessidade de mais estudos desse tipo na área.
Alguns esportes apresentam grandes taxas de eventos concussivos ou traumáticos. Um único artigo com modelo experimental in vivo avaliou diversos sintomas decorrentes da indução de concussão em camundongos (BELARDO e colab., 2019). O tratamento com CBD de camundongos que sofreram concussão aliviou a alodinia tátil (sensação de sentir dor em estímulos que normalmente não seriam dolorosos) em comparação ao controle. Já o tratamento com CBD em camundongos que não tiveram a concussão induzida, não alterou os parâmetros analisados significativamente. O grupo CBD + concussão também teve melhora no parâmetro de recuo durante teste de coordenação motora e ansiedade, além da agressividade, avaliada por meio de número de ataques pósindução do trauma, onde o grupo que recebeu CBD como tratamento apresentou metade do número de ataques (9.9 ± 1.84 contra 20.20 ± 2.99). Animais que receberam CBD também tiveram menor comportamento depressivo (caracterizado pela imobilidade no reflexo de escapatória orientado, onde o tempo foi para 125.1 s ± 8.95 de 169.4 s ± 5.93 do controle). Finalizando, o padrão de neurotransmissores, alterado nos animais com trauma induzido e sem tratamento, foi normalizado e/ou revertido nos animais que receberam CBD (como glutamato, D-aspartato e GABA) no período pós 14 dias de trauma, porém diferenças não foram mais observadas no período final de 60 dias (BELARDO e colab., 2019). Esses resultados são extremamente interessantes e abrem caminhos que devem ser extensivamente mais explorados em modelos semelhantes, mas também em ensaios clínicos e coortes.
Se tratando de algo comum em todos os esportes, Isenmann e colaboradores (2021) avaliaram melhoras nos padrões de recuperação muscular esquelética e de performance em 16 participantes saudáveis. O experimento foi bem controlado, incluindo períodos de restrição de consumo de substâncias que pudessem interferir nas avaliações, avaliação pré tratamento e pós 24, 48 e 72h de testes bioquímicos e de performance. Após única suplementação com 60 mg de CBD e protocolo único de treino intenso, diferenças pouco significativas foram observadas após 72h nas quantidades de creatina-quinase (CK) e mioglobina plasmática, o que os autores sugerem ser um indicativo de, havendo efeitos interessantes nessa suplementação, provavelmente os resultados seriam melhor aproveitados em um uso contínuo e a longo prazo. Entretanto, também é necessário que mais estudos semelhantes com foco em regeneração muscular e melhora de performance sejam realizados para estabelecimento de conclusões mais substanciais (ISENMANN e colab., 2021).
Fugindo um pouco da área relacionada à saúde, mas também totalmente fundamental ao esporte, 5.0 s ± 1.0 um estudo com 16 participantes do sexo masculino, saudáveis e em boa forma física, avaliou o tratamento sublingual de óleo de CBD (11 mg, 4 gotas) ou placebo no tempo de reação dos participantes.
Após 30 minutos da administração, os reflexos foram avaliados. Nenhuma alteração significativa foi observada tanto em tempos de reação simples quanto em tempos de reação complexos. Os autores realçam que as conclusões não puderam ser precisadas por uma série de motivos (ŠKOPEK e colab., 2021). Primeiramente, não existem estudos semelhantes para comparação nesse tópico, já que o foco de trabalho com CBD é maior em atribuições à saúde, e não em tempo de reação. Outro ponto é o número amostral pequeno, onde os autores sugerem também uma repetição do experimento em uma larga escala. Um fator não levantado pelos autores, mas que como já foi discutido acima no contexto de dor em doenças inflamatórias intestinais, mereceria um destaque, seria a baixa dose utilizada no experimento a ponto de ser possivelmente significativa.
20.7 Alimentos que interagem com o sistema endocanabinóide
Com o foco de exploração sobre as modulações no sistema endocanabinóide e seus diversos receptores (exemplificados e profundamente discutidos no capítulo XX deste guia), se torna necessário o aprofundamento em duas áreas de interesse majoritárias: I) farmacológica, tratada com mais intensidade em outros capítulos deste livro e II) ambiental, aqui podendo ser dividida nas diversas atividades comportamentais que podem influenciar neste sistema e ainda nos alimentos e nutrientes capazes de modular ou ao menos interagir com componentes distintos do sistema endocanabinóide.

O tipo de dieta e hábitos alimentares pode influenciar de diferentes maneiras no consumo de lipídeos com potencial de interação com nossos sistemas endocanabinóides. N-acilfosfatidiletanolaminas (NAPE’s), N-aciletanolaminas (NAE’s), anandamida e 2-araquidonilgliceraol são exemplos de compostos estão presentes em plantas, animais bactérias e leveduras. A quantidade destes nos alimentos, principalmente em relação aos animais, variam de acordo com o conteúdo lipídico das dietas e seus tipos. Uma simulação de consumo com 43 diferentes fontes alimentares demonstrou que as dietas do tipo mediterrânea e vegetariana apresentaram maior teor de consumo diário de NAPE’s e de NAE’s (263 e 0.25 mg/dia para mediterrânea e 242 e 0.28 mg/dia para vegetariana, respectivamente), enquanto para os endocanabinóides, os valores foram próximos entre a dieta ocidental e a mediterrânea, com a dieta vegetariana muito atrás desses valores (0.17mg/dia contra 0.01mg/dia). A anandamida e o 2- araquidoilglicerol foram quase que exclusivos de fontes animais (DE LUCA e colab., 2019).
Em um outro exemplo, a livre disponibilidade de uma dieta rica em açúcar e gordura pode induzir diferentes níveis de expressão de receptores endocanabinóides e enzimas relacionadas aos processos de síntese e degradação de compostos como a anandamida, um dos principais endocanabinóides estudados, em regiões cerebrais distintas. Em ratos Wistar, esse tipo de dieta foi capaz de diminuir a expressão da enzima que degrada a anadamida (FAAH) e aumentar a expressão da enzima que sintetiza esse composto (NAPE-PLD) na região do núcleo Accumbens. Nessa região também foi identificada uma menor quantidade do composto 2-AG (2-araquidonilglicerol) circulante e uma maior quantidade de receptores CB2 e GPCR55 dos ratos consumidores de altas doses de açúcar. Essas alterações podem estar relacionadas com processos inflamatórios na micróglia, alterar padrões de alimentação e modulações de resposta e disparos de neurotransmissores nas redes cerebrais, principalmente relacionados a dopamina e GABA (BOURDY e colab., 2021).
Também, durante o processo gestacional e lactacional, uma dieta com altas quantidades de gordura pode influenciar em alterações moleculares relacionadas ao sistema endocanabinoide, como observado em filhotes de ratos Wistar. Curiosamente, neste estudo, os achados foram em parte dependentes do sexo das crias. No parto, enquanto machos apresentaram leptinemia diminuída e aumento hipotalâmico de CB1, orexina-A, pró-opiomelanocortina (POMC), diminuição do hormônio liberador de tireotrofina (TRH) e CB1 no tecido adiposo marrom, as crias fêmeas apresentaram aumento de CB2 tanto no hipotálamo quanto no tecido adiposo marrom. Todas as crias desenvolveram sobrepeso, aumento de gordura corporal e preferência pela dieta de alto teor de gorduras, independentemente do sexo (DIAS-ROCHA e colab., 2018). Também podemos colocar em perspectiva uma forma mais isolada de análise, levando em consideração alimentos como fontes desses endocanabinoides e compostos similares, e não apenas os padrões dietéticos.
Por exemplo, em 1996 di Tomaso, Beltramo e Piomelli realizaram cromatografia gasosa e líquida de diferentes amostras de chocolate e cacau, identificando três Nacetiletanolaminas saturadas que poderiam atuar como mímicos canabinóides diretamente (ativando receptores canabinóides como CB1 e CB2) ou indiretamente (aumentando os níveis de anandamida, por diminuição da hidrólise desta no cérebro). Ainda que uma parte dos efeitos observados pela sensação de “chocolate craving” possa ser proveniente das metilxantinas (teobromina e cafeína por exemplo), os autores indicam que parte desse efeito talvez possa vir proveniente desses compostos, ou então que haja algum nível de sinergia entre eles, uma vez que os níveis aumentados de anandamida decorrentes de uma menor hidrólise, possa junto com as metilxantinas produzir uma sensação de bem-estar. Claro que, para especificamente esses efeitos, ainda é necessária uma vasta exploração experimental que estabeleça vínculos mais significativos e bem fundamentados, mas a presença dos compostos já foi identificada (DI TOMASO e colab., 1996).
O sesquiterpeno (E)-β-cariofileno está presente em óleos essenciais de diferentes espécies de plantas, como orégano, canela e pimenta preta, assim como amplamente na Cannabis sativa L. Gertsch e colaboradores (2008) separaram os compostos do óleo essencial da C. sativa e identificaram o (E)-βcariofileno como composto ligante do receptor CB2, seletivamente, uma vez que os isômeros desse composto não tiveram ligação significativa com o receptor CB1. Outros terpenos presentes no óleo também não interagiram de forma convincente com qualquer um dos dois receptores. Os autores também indicaram a possibilidade da ligação no receptor CB2 ser na mesma região que o tetrahidrocanabinol (THC), o que tornaria o (E)-β-cariofileno um agonista competitivo desse receptor (GERTSCH, Jürg e colab., 2008). Essas informações são interessantes do ponto de vista de alvo terapêutico, buscando minimizar possíveis efeitos colaterais de quantidades de THC presentes nos óleos essenciais extraídos dessas fontes de outros canabinóides (GERTSCH, Jürg e colab., 2008). Outros possíveis agonistas do receptor CB2 são as alquilamidas da flor Echinacea spp, que apresentam fórmulas estruturais semelhantes à anandamida e 2-araquidoilglicerol, com uma indução de até 11 vezes de aumento de fator de necrose tumoral – alfa em monócitos e macrófagos humanos, também aumentando a expressão do seu mRNA (GERTSCH, Juerg e colab., 2004).
Canabidiol, anandamida e a capsaicina (Capsicum annuum), por exemplo, compartilham a característica de serem agonistas do TRPV1 seletivamente, assim como esse traço é compartilhado com outras plantas como pimenta preta (Piper nigrum) e gengibre (Zingiber officinale). Eles se dividem nas classes irritativas e não-irritativas. Mesmo os compostos capazes de gerarem respostas de dor, como é o caso da capsaicina, a constante exposição acaba por realizar um efeito de dessensibilização do receptor TRPV1, o que pode se tornar uma área de interesse experimental para fins terapêuticos relacionados à dor (RUSSO, Ethan B., 2016).
Indiretamente, o flavonóide Kaempferol, encontrado em maçãs, amoras e no gengibre tailândes (galanga, Kaempferia galanga) pode influenciar o sistema endocanabinóide pela inibição da Hidrolase amida de ácido graxo (FAAH) com alta especificidade (Ki de 5 µM) (THORS e colab., 2008). Hipoteticamente, o consumo de altas doses de kaempferol poderia aumentar a anadamida sérica por consequência. Duas N-benzilamidas da maca peruana (Lepidium meyenii) também atuaram como inibidores (menos potentes) dessa enzima (WU e colab., 2013). Estudos sobre absorção e chegada desses compostos no sistema nervoso central (passagem pela barreira hematoencefálica) ainda precisam ser realizados para conclusões mais certeiras.
Até mesmo a modulação da microbiota pode participar do sistema endocanabinóide de alguma forma ainda não muito bem esclarecida. Por exemplo, a cepa Lactobacillus acidophilus NCFM foi capaz de induzir expressão de mRNA do receptor canabinóide do tipo 2 (CNR2) em células epiteliais humanas e amenizou a dor em ratos (ROUSSEAUX e colab., 2007). A especificidade desses achados no cenário humano, com maiores fontes de evidência ainda carece de ser explorada, mas indica caminhos interessantes a serem trilhados.
No geral se observa que a alimentação, seja por proporções de consumo de diferentes nutrientes (especialmente gorduras e açúcar), compostos fitoquímicos presentes em uma ampla variedade de raízes, folhas, frutos e flores, ou ainda por uma possível influência da microbiota em todo o processo de expressão e atividade de receptores do sistema endocanabinóide, é fundamental como área de interesse, tanto tecnológico e científico, quanto possivelmente comercial, na medida em que esses efeitos são cada vez mais descritos e estabelecidos com parâmetros lógicos dentro da literatura.
20.8 Cânhamo e nutrição animal
O exercício de atividades relacionadas com o cultivo, fabricação, comércio por grosso, transporte, circulação, importação e exportação de medicamentos, preparações e substâncias à base da planta da cannabis, diferenciando-se das finalidades medicinais, é regido e regulamentado pela Portaria n. º 83/2021 e atualizada/esclarecida pela Portaria n. º 14/2022 da Direção-Geral da Alimentação e Veterinária (DGAV).
Sementes e rações preparadas à base de sementes de cânhamo acabam tendo uma vasta quantidade de nutrientes, entre eles flavonóides, terpenos e terpenóides, fitocanabinóides, proteínas, fibras e gorduras insaturadas, além de vitaminas e minerais. Essa composição coloca essa matriz como um alimento de alta qualidade nutricional para a alimentação de animais. Essa utilização já foi encorajada em 2011 pela Autoridade Europeia em Segurança Alimentar (EFSA), onde é detalhado diversos ensaios para avaliação de quantidades toxicologicamente viáveis de inclusão na dieta de uma ampla gama de animais de pasto, domésticos e humanos, concluindo-se que o uso nutricional em alimentação animal é viável desde que respeitadas quantidades determinadas para cada espécie (EFSA, 2011).
Alguns estudos em animais de fazenda foram realizados para avaliar a inclusão de sementes de cânhamo ou derivados nas rações. Enquanto “hempseed meal” se refere geralmente ao produto derivado de uma extração com solventes para remoção de gordura, “hempseed cake”, ou bolo de cânhamo (HC) em tradução literal, termo que será recorrente no capítulo, é o produto da semente de cânhamo após prensa fria para extração de lipídeos, sendo um alimento rico em proteínas e com menores teores de gordura quando às sementes. Consequentemente, as sementes possuem maior teor de gorduras, enquanto o HC acaba sendo mais concentrado em proteínas. Em frangos de corte, Khan e colaboradores (2010) observaram um aumento de peso significativo quando adicionado 20% de sementes às rações padrão (KHAN e colab., 2010). Já autores que utilizaram menores doses, entre 2,5 e 15% não observaram esses mesmos aumentos, inclusive foram identificadas reduções no peso em comparação aos controles (ERIKSSON e WALL, 2012; JING e colab., 2017; MAHMOUDI e colab., 2015; ONDREJ e colab., 2015; SKŘIVAN e colab., 2020).
Já em galinhas de ovos, o peso dos ovos parece ter sido influenciado pela substituição alimentar com 20% de sementes de cânhamo (GAKHAR e colab., 2012), e também em quantidades menores, entre 3 e 9%, (MIERLIŢĂ, 2019; SKŘIVAN e colab., 2020). A qualidade do perfil lipídico também parece ter sido influenciada de alguma forma, aumentando as concentrações de ácido linolênico (ômega-3) e linoléico (ômega-6), diminuindo quantidades de monoinsaturados e saturados com adição de HC entre 5 e 15% (HALLE e SCHÖNE, 2013), óleo de semente de cânhamo entre 4,5 e 9%, e apenas sementes (10, 20 e 30%) (NEIJAT et al., 2016). Essas maiores quantidades repercutiram nos maiores índices de ALA e DHA. Mierliţă e colaboradores (2019) também identificaram maiores quantidades de alfa-tocoferol na gema dos ovos das galinhas que receberam a ração com sementes ou outro derivado, o que sinaliza um maior padrão de qualidade antioxidante nesses produtos, fora o valor nutricional para o consumo humano (MIERLIŢĂ, 2019).

Nas classes dos ruminantes, por exemplo nas vacas, o aumento de rendimento de leite foi observado com a adição de sementes ou HC na menor quantidade (143 mg/kg), com efeito de diminuição da conversão de proteína dietética em proteínas do leite em doses maiores (233 mg/kg e 318 mg/kg de matéria seca) (KARLSSON et al., 2010). Em ovelhas, 25% de sementes adicionadas na dieta gerou maiores quantidades de gordura do leite, sem influenciar no nível de proteínas. A inclusão de sementes em 180 g/d e HC em 480 g/d foi eficaz em aumentar rendimento de leite e teor de gordura do leite. Ambas aumentaram a concentração de ALA no leite de ovelha (66 e 49% respectivamente), junto do aumento em poliinsaturados, monoinsaturados e lipídios de cadeia longa (MIERLITA, 2016).
Os dados acima tratados foram muito bem revisados, compilados e discutidos por della Rocca e di Salvo (2018), além de serem complementados com dados de estudos sobre riscos, valores nutracêuticos e farmacêuticos da Cannabis (DELLA ROCCA e DI SALVO, 2020). Até mesmo transcriptoma de ovelhas que receberam 5% de sementes de cânhamo na dieta foi analisado, ou os genes aparentemente influenciados foram aqueles relacionados ao metabolismo energético, refletindo em maiores níveis de lactose no leite destas (IANNACCONE e colab., 2019).
Sobre o teor de proteínas nas sementes, em nutrição temos que o seu valor biológico é determinado a partir das diferentes quantidades presentes dos 21 tipos de aminoácidos, e um alimento é estabelecido como de alto valor quando este apresenta quantidades interessantes de todos os aminoácidos essenciais (FAO 1991). No caso da semente de cânhamo, ela permaneceu próxima à proteína de soja e de colza em aminoácidos sulfurados, mas níveis de lisina (seu aminoácido limitante), triptofano e treonina foram menores (CALLAWAY, 2004).
Um problema na adição dessas sementes e derivados na alimentação animal pode ser o alto teor de fatores antinutricionais, como os fitatos, que podem agir como quelantes de nutrientes formando um composto insolúvel, uma vez que sua quantidade supera 5% na matriz (RUSSO, Roberto, 2013). Isso indica uma necessidade de suplementação de alguns compostos, e também a nãosubstituição completa do tipo de ração (GÜRDOǦAN e colab., 2006). Entretanto, a absorção de ferro pode em algum grau ser melhorada, como observado por Reggiani e Russo, em que uma troca de 6,4% na matéria seca de milho ou soja por semente de cânhamo ou linho aumentou a disponibilidade de ferro em cabras lactantes (REGGIANI e RUSSO, 2016).
Esses achados em animais que são comumente utilizados em escala comercial se tornam alvos interessantes de mais estudos semelhantes para avaliação de melhora dos produtos obtidos a partir dessa inclusão dietética/suplementar, ao mesmo tempo que se controla possíveis efeitos adversos indesejados.
Outra área de grande interesse nos dias atuais, com as flexibilizações mundo afora, é a utilização nutracêutica/nutricional dos compostos derivados da Cannabis para animais domésticos. Em cultura celular de sangue completo doado por 6 cães, a incubação com CBD minimizou o cenário inflamatório derivado da exposição prévia ao lipolissacarídeo (LPS), diminuindo a razão TNFalfa/IL-10 (o que significa mais citocina IL-10 antiinflamatória contrapondo a presença de TNF-alfa pró-inflamatório), e diminuindo quantidades de IL-6. O CBD também diminuiu expressão proteica e de mRNA das vias COX-2 e NF-kB (GUGLIANDOLO e colab., 2021).
Em se tratando de comportamento animal, azeite de oliva associado com 5% de CBD foi eficaz em amenizar o comportamento agressivo à humanos de cães em abrigos após 45 dias do início do tratamento, enquanto no grupo controle (sem tratamento com 5% de CBD) não houve essa melhora. Os animais também não tiveram efeitos observados relacionados à intolerância ao CBD (CORSETTI e colab., 2021).
Sobre segurança de consumo, a inclusão de CBD (em óleo de triglicerídeos de cadeia média – TCM) em doses de 1 a 12 mg/kg por 28 dias foi bem tolerada em Beagles saudáveis adultos em situação experimentalmente controlada, sem nenhuma alteração clínica, funcional ou morfológica observada comparativamente ao controle. Os cachorros que receberam 12 mg/kg, no entanto, apresentaram maiores níveis séricos de fosfatase alcalina, que não repercutiu em qualquer efeito clínico relevante, e os autores sugerem como uma adaptação metabólica inicial à exposição do CBD. Hipersalivação foi observada nesse grupo que recebeu 12 mg/kg, com aumento significativo posteriormente a administração do CBD (29% [9/31] de ocorrências para 71% [22/31] ocorrências) (VAUGHN e colab., 2021).
Em outro estudo, cães e gatos adultos e saudáveis foram avaliados durante consumo de pastilhas nutracêuticas mastigáveis contendo CBD. As doses foram padronizadas em 2 mg/kg duas vezes ao dia, por 84 dias. No geral, nenhum animal apresentou diferenças significativas nos padrões sorológicos ou outros problemas clínicos observáveis, demonstrando uma boa tolerância dos caninos e felinos ao consumo diário de CBD. No entanto, os autores alertam para um caso de apenas um gato que teve o nível de ALT (alanina transferase, marcador de atividade hepática) aumentado persistentemente acima dos padrões de referência, e por isso recomendaram que mais estudos acompanhando esses marcadores sejam realizados, além de experimentos associando o CBD à outras drogas metabolizadas pelo fígado para visualização de possíveis problemas (DEABOLD e colab., 2019).
Kulpa e colaboradores (2021) em outro estudo randomizado, agora apenas com gatos, também saudáveis, testaram três tratamentos distintos: um apenas com CBD, outro com THC e um com mistura dos dois compostos (os dois isolados veiculados em TCM e o último veiculado em óleo de girassol), todos em doses escalonáveis, chegando até 30,5 e 41,5 mg/kg nos compostos isolados e 13,0:8,4 mg/kg no óleo com ambos. Enquanto efeitos adversos como letargia, hipotermia, ataxia e protrusão de membrana nictitante foram observados nos grupos contendo THC (THC e CBD/THC), sintomas gastrointestinais (principalmente vômitos e hipersalivação) foram observados nos grupos que receberam o veículo TCM. Outros problemas clínicos relevantes não foram observados pelos autores (KULPA e colab., 2021).
Já em cachorros com osteoartrite, cães que receberam CBD na dose de 2 mg/kg apresentaram melhora em dois “scores”, um relacionado a dor (Canine brief pain inventory) e outro relacionado a atividade (Hudson activity), enquanto não foram observados ou relatados efeitos adversos. Novamente aqui, entretanto, houve aumento sérico da enzima fosfatase alcalina durante o tratamento com óleo contendo CBD (GAMBLE e colab., 2018).
No geral, é possível concluir que nas doses testadas demonstradas na literatura aqui citada, a segurança da suplementação alimentar de CBD veiculado em diferentes óleos (especialmente TCM) é presente, ainda que haja necessidade de mais estudos para confirmação desses dados em diferentes faixas etárias, condições patológicas e entre outras variáveis, além de potencialmente ter efeitos interessantes em diferentes contextos aplicáveis (YU RUPASINGHE, 2021).
Referências
Adesina, Ifeoluwa, et al. “A review on the current state of knowledge of growing conditions, agronomic soil health practices and utilities of hemp in the United States.” Agriculture 10.4 (2020): 129.
Aguiar, Stephanne Pereira de. “O panorama legislativo e político da maconha na América do Sul: uma revisão bibliográfica.” (2016).
Baldino, Noemi, et al. “Formulation of bread model doughs with resistant starch, vegetable proteins and transglutaminase.” European Food Research and Technology 246.3 (2020): 397- 408.
Barrus, Daniel G., et al. “Tasty THC: promises and challenges of cannabis edibles.” Methods report (RTI Press) 2016 (2016).
Brasil, Ministério da agricultura, Pecuária e Abastecimento. Manual de hortaliças não convencionais. Secretaria de Desenvolvimento Agropecuário e Cooperativismo. Brasília: mapa/ACS, 2010
BEDINI, Stefano e colab. Cannabis sativa and Humulus lupulus essential oils as novel control tools against the invasive mosquito Aedes albopictus and fresh water snail Physella acuta. Industrial Crops and Products, v. 85, p. 318–323, 2016. Disponível em: http://dx.doi.org/10.1016/j.indcrop.2016.03.008.
BELARDO, Carmela e colab. Oral cannabidiol prevents allodynia and neurological dysfunctions in a mouse model of mild traumatic brain injury. Frontiers in Pharmacology, v. 10, n. MAR, p. 1–11, 2019.
BENELLI, Giovanni e PAVELA, Roman e LUPIDI, Giulio e colab. The crop-residue of fiber hemp cv. Futura 75: from a waste product to a source of botanical insecticides. Environmental Science and Pollution Research, v. 25, n. 11, p. 10515–10525, 2018.
BENELLI, Giovanni e PAVELA, Roman e PETRELLI, Riccardo e colab. The essential oil from industrial hemp (Cannabis sativa L.) by-products as an effective tool for insect pest management in organic crops. Industrial Crops and Products, v. 122, n. February, p. 308–315 Disponível em: https://doi.org/10.1016/j.indcrop.2018.05.032.
Bielawiec, Patrycja et al. “Phytocannabinoids: Useful Drugs for the Treatment of Obesity? Special Focus on Cannabidiol.” Frontiers in endocrinology vol. 11 114. 4 Mar. 2020, doi:10.3389/fendo.2020.00114
Boisvert, Esthelle Ewusi, et al. “Subjective effects of combustible, vaporized, and edible cannabis: Results from a survey of adolescent cannabis users.” Drug and alcohol dependence 206 (2020): 107716.
BOURDY, Romain e colab. The endocannabinoid system is modulated in reward and homeostatic brain regions following diet-induced obesity in rats: a cluster analysis approach. European Journal of Nutrition, v. 60, n. 8, p. 4621–4633, 2021. Disponível em: https://doi.org/10.1007/s00394-021-02613-0.
BRASIL. Resolução n.º 4.134, de 29 de outubro de 2021. Diário oficial da União da República Federativa do Brasil. ed. 207 pág. 349. Seção 1. 04 de nov. de 2021.
BRASIL. Resolução da diretoria colegiada – RDC nº 327, de 9 de dez. de 2019. Diário Oficial da União da República Federativa do Brasil. ed. 239. pág. 194. Seção 1. 11 de dez. de 2019.
BURR, Jamie F. e colab. Cannabis and Athletic Performance. Sports Medicine, v. 51, n. s1, p. 75–87, 2021. Disponível em: https://doi.org/10.1007/s40279-021-01505-x.
Callaway, Joseph C. “Hempseed as a nutritional resource: An overview.” Euphytica 140.1 (2004): 65-72.
Callaway, J. C., T. Tennilä, and D. W. Pate. “Occurrence of “omega-3” stearidonic acid (cis6, 9, 12, 15-octadecatetraenoic acid) in hemp (Cannabis sativa L.) seed.” J Int Hemp Assoc 3 (1997): 61-63.
Carlini, Elisaldo Araújo. “A história da maconha no Brasil.” Jornal brasileiro de psiquiatria 55 (2006): 314-317.
Celestino, Leticia Kefler, Marla Leite Marconato, and Bruno Elias Rocha Lopes. “MACONHA NA SAÚDE: Uma revisão bibliográfica sobre uso terapêutico da Cannabis sativa.” Revista da Saúde da AJES 7.13 (2021).
Cerino, Pellegrino et al. “A Review of Hemp as Food and Nutritional Supplement.” Cannabis and cannabinoid research vol. 6,1 19-27. 12 Feb. 2021, doi:10.1089/can.2020.0001
CLARKE, Robert C. e MERLIN, Mark D. Cannabis: Evolution and ethnobotany. University of California Press. p. 53. 2013.
CORSETTI, Sara e colab. Cannabis sativa L. may reduce aggressive behaviour towards humans in shelter dogs. Scientific Reports, v. 11, n. 1, p. 1–10, 2021. Disponível em: https://doi.org/10.1038/s41598-021-82439-2.
Decuyper, I. I., et al. “Cannabis sativa allergy: looking through the fog.” Allergy 72.2 (2017): 201- 206.
DE LUCA, Lucia e FERRACANE, Rosalia e VITAGLIONE, Paola. Food database of N-acylphosphatidylethanolamines, N-acylethanolamines and endocannabinoids and daily intake from a Western, a Mediterranean and a vegetarian diet. Food Chemistry, v. 300, n. July 2018, p. 125218, 2019. Disponível em: https://doi.org/10.1016/j.foodchem.2019.125218.
DE OLIVEIRA CARVALHO, Helison e colab. Actions of Cannabis sativa L. fixed oil and nanoemulsion on venom-induced inflammation of Bothrops moojeni snake in rats. Inflammopharmacology, v. 29, n. 1, p. 123–135, 2021. Disponível em: https://doi.org/10.1007/s10787-020-00754-y.
DEABOLD, Kelly A e colab. Safety Assessment with Use of CBD-Rich Hemp Nutraceutical in Healthy Dogs and Cats. Animals, v. 9, n. 10, p. 1–13, 2019.
DELLA ROCCA, Giorgia e DI SALVO, Alessandra. Hemp in Veterinary Medicine: From Feed to Drug. Frontiers in Veterinary Science, v. 7, n. July, p. 1–11, 2020.
DEVI, Vibha e KHANAM, Shabina. Comparative study of different extraction processes for hemp (Cannabis sativa) seed oil considering physical, chemical and industrial-scale economic aspects. Journal of Cleaner Production, v. 207, p. 645–657, 2019. Disponível em: https://doi.org/10.1016/j.jclepro.2018.10.036.
DI TOMASO, E. e BELTRAMO, M. e PIOMELLI, D. Brain cannabinoids in chocolate. Nature. [S.l: s.n.]. , 1996
DIAS-ROCHA, Camilla P. e colab. Maternal high-fat diet induces sex-specific endocannabinoid system changes in newborn rats and programs adiposity, energy expenditure and food preference in adulthood. Journal of Nutritional Biochemistry, v. 51, p. 56–68, 2018. Disponível em: https://doi.org/10.1016/j.jnutbio.2017.09.019.
DOCTER, Shgufta e colab. Cannabis Use and Sport: A Systematic Review. Sports Health, v. 12, n. 2, p. 189–199, 2020.
ECONOMIA E TRANSIÇÃO DIGITAL, FINANÇAS, ADMINISTRAÇÃO INTERNA, JUSTIÇA, SAÚDE E AGRICULTURA. BRASIL. Portaria n.º 83 de 15 de abril de 2021. Diário Oficial da União da República Federativa do Brasil. ed. 73. pág. 5. 15 de abril de 2021. ECONOMIA E TRANSIÇÃO DIGITAL, FINANÇAS, ADMINISTRAÇÃO INTERNA, JUSTIÇA, SAÚDE E AGRICULTURA. BRASIL. Portaria n.º 14 de 5 de jan. de 2022. Diário Oficial da União da República Federativa do Brasil. ed. 3. pág. 20. 05 de jan. 2021.
EFSA. Scientific Opinion on the safety of hemp (Cannabis genus) for use as animal feed. EFSA Journal, v. 9, n. 3, p. 1–41, 2011.
ERIKSSON, M. e WALL, H. Hemp seed cake in organic broiler diets. Animal Feed Science and Technology, v. 171, n. 2–4, p. 205–213, 2012. Disponível em: http://dx.doi.org/10.1016/j.anifeedsci.2011.10.007.
FAO; WHO; UNU. Protein Quality Evaluation: Report of a Joint FAO/WHO/UNU Expert Consultation. 1991.
Farinon, Barbara et al. “The seed of industrial hemp (Cannabis sativa L.): Nutritional Quality and Potential Functionality for Human Health and Nutrition.” Nutrients vol. 12,7 1935. 29 Jun. 2020, doi:10.3390/nu12071935.
Farmer, Stacey, et al. “Aversiveness and meaningfulness of uncomfortable experiences with edible cannabis.” Journal of psychoactive drugs 51.5 (2019): 413-420.
Fetterman, Patricia S., et al. “Mississippi-grown Cannabis sativa L.: Preliminary observation on chemical definition of phenotype and variations in tetrahydrocannabinol content versus age, sex, and plant part.” Journal of Pharmaceutical Sciences 60.8 (1971): 1246-1249.
FIORINI, Dennis e colab. Valorizing industrial hemp (Cannabis sativa L.) by-products: Cannabidiol enrichment in the inflorescence essential oil optimizing sample pre-treatment prior to distillation. Industrial Crops and Products, v. 128, n. May 2018, p. 581–589, 2019. Disponível em: https://doi.org/10.1016/j.indcrop.2018.10.045.
GAKHAR, N. e colab. Effect of feeding hemp seed and hemp seed oil on laying hen performance and egg yolk fatty acid content: Evidence of their safety and efficacy for laying hen diets. Poultry Science, v. 91, n. 3, p. 701–711, 2012.
GAMBLE, Lauri Jo e colab. Pharmacokinetics, Safety, and Clinical Efficacy of Cannabidiol Treatment in Osteoarthritic Dogs. Frontiers in Veterinary Science, v. 5, n. July, p. 1–9, 2018.
Gao, Zili, et al. “Effect of alkaline extraction pH on structure properties, solubility, and beany flavor of yellow pea protein isolate.” Food Research International 131 (2020): 109045
GERTSCH, Juerg e colab. Echinacea alkylamides modulate TNF-α gene expression via cannabinoid receptor CB2 and multiple signal transduction pathways. FEBS Letters, v. 577, n. 3, p. 563–569, 2004.
GERTSCH, Jürg e colab. Beta-caryophyllene is a dietary cannabinoid. Proceedings of the National Academy of Sciences of the United States of America, v. 105, n. 26, p. 9099–9104, 2008.
Gertsch, Jürg. “Cannabimimetic phytochemicals in the diet–an evolutionary link to food selection and metabolic stress adaptation?.” British journal of pharmacology 174.11 (2017): 1464-1483.
GUGLIANDOLO, Enrico e colab. Effect of cannabidiol (Cbd) on canine inflammatory response: An ex vivo study on lps stimulated whole blood. Veterinary Sciences, v. 8, n. 9, 2021.
GÜRDOǦAN, Fuat e YILDIZ, Atilla e BALIKCI, Engin. Investigation of serum Cu, Zn, Fe and Se concentrations during pregnancy (60, 100 and 150 days) and after parturition (45 days) in single and twin pregnant sheep. Turkish Journal of Veterinary and Animal Sciences, v. 30, n. 1, p. 61–64, 2006.
Hadnađev, Miroslav, et al. “Hempseed meal protein isolates prepared by different isolation techniques. Part I. physicochemical properties.” Food hydrocolloids 79 (2018): 526-533.
HALLE, Ingrid e SCHÖNE, Friedrich. Influence of rapeseed cake, linseed cake and hemp seed cake on laying performance of hens and fatty acid composition of egg yolk. Journal fur Verbraucherschutz und Lebensmittelsicherheit, v. 8, n. 3, p. 185–193, 2013.
House, James D., Jason Neufeld, and Gero Leson. “Evaluating the quality of protein from hemp seed (Cannabis sativa L.) products through the use of the protein digestibility-corrected amino acid score method.” Journal of agricultural and food chemistry 58.22 (2010): 11801-11807.
IANNACCONE, Marco e colab. Whole blood transcriptome analysis in ewes fed with hemp seed supplemented diet. Scientific Reports, v. 9, n. 1, p. 2–10, 2019. Disponível em: http://dx.doi.org/10.1038/s41598-019-52712-6.
Iftikhar, Amna, et al. “Applications of Cannabis Sativa L. in Food and Its Therapeutic Potential: From a Prohibited Drug to a Nutritional Supplement.” Molecules 26.24 (2021): 7699.
IRVING, Peter M. e colab. A Randomized, Double-blind, Placebo-controlled, Parallel-group, Pilot Study of Cannabidiol-rich Botanical Extract in the Symptomatic Treatment of Ulcerative Colitis. Inflammatory Bowel Diseases, v. 24, n. 4, p. 714–724, 2018.
ISENMANN, Eduard e colab. Effects of cannabidiol supplementation on skeletal muscle regeneration after intensive resistance training. Nutrients, v. 13, n. 9, 2021.
JING, M. e ZHAO, S. e HOUSE, J. D. Performance and tissue fatty acid profile of broiler chickens and laying hens fed hemp oil and HempOmegaTM. Poultry Science, v. 96, n. 6, p. 1809–1819, 2017.
KARLSSON, L. e FINELL, M. e MARTINSSON, K. Effects of increasing amounts of hempseed cake in the diet of dairy cows on the production and composition of milk. Animal, v. 4, n. 11, p. 1854–1860, 2010. Disponível em: http://dx.doi.org/10.1017/S1751731110001254.
KASPER, Andreas M. e colab. High prevalence ofcannabidiol use within male professional rugby union and league players: A quest for pain relief and enhanced recovery. International Journal of Sport Nutrition and Exercise Metabolism, v. 30, n. 5, p. 315–322, 2020.
KELEN, M. E. B.; NOUHUYS, I. S. V.; KEHL, L. C.; BRACK. P.; SILVA, D.B. Plantas alimentícias não convencionais (PANCs): hortaliças espontâneas e nativas. (1ª ed.). UFRGS,PortoAlegre, 2015.
KHAN, Rifat Ullah e colab. Influence of Feed Supplementation with Cannabis Sativa on Quality of Broilers Carcass. Pakistan Veterinary Journal, v. 30, n. 1, p. 34–38, 2010. Disponível em: http://www.pvj.com.pk/pdf-files/31_3/192-194.pdf.
KULPA, Justyna E. e colab. Safety and tolerability of escalating cannabinoid doses in healthy cats. Journal of Feline Medicine and Surgery, v. 23, n. 12, p. 1162–1175, 2021.
Leizer, Cary, et al. “The composition of hemp seed oil and its potential as an important source of nutrition.” Journal of Nutraceuticals, functional & medical foods 2.4 (2000): 35-53.
Leonard, William, et al. “Hempseed in food industry: Nutritional value, health benefits, and industrial applications.” Comprehensive reviews in food science and food safety 19.1 (2020): 282- 308.
Leventhal, Adam M., et al. “Psychiatric comorbidity in adolescent use and poly-use of combustible, vaporized, and edible cannabis products.” Journal of psychiatric research 124 (2020): 91-98.
LINARES, Ila M.P. e colab. No acute effects of Cannabidiol on the sleep-wake cycle of healthy subjects: A randomized, double-blind, placebo-controlled, crossover study. Frontiers in Pharmacology, v. 9, n. APR, p. 1–8, 2018.
MAHMOUDI, Mohammad e FARHOOMAND, Parviz e NOURMOHAMMADI, Rouhollah. Effects of different levels of hemp seed (Cannabis sativa L.) and dextran oligosaccharide on growth performance and antibody titer response of broiler chickens. Italian Journal of Animal Science, v. 14, n. 1, p. 114–119, 2015.
Martínez, Vicente et al. “Cannabidiol and Other Non-Psychoactive Cannabinoids for Prevention and Treatment of Gastrointestinal Disorders: Useful Nutraceuticals?.” International journal of molecular sciences vol. 21,9 3067. 26 Apr. 2020, doi:10.3390/ijms21093067
MIERLITA, D. Fatty acid profile and health lipid indices in the raw milk of ewes grazing parttime and hemp seed supplementation of lactating ewes. South African Journal of Animal Sciences, v. 46, n. 3, p. 237–246, 2016.
MIERLIŢĂ, D. Fatty acids profile and oxidative stability of eggs from laying hens fed diets containing hemp seed or hempseed cake. South African Journal of Animal Sciences, v. 49, n. 2, p. 311–321, 2019.
NAFTALI, Timna e colab. Low-Dose Cannabidiol Is Safe but Not Effective in the Treatment for Crohn’s Disease, a Randomized Controlled Trial. Digestive Diseases and Sciences, v. 62, n. 6, p. 1615–1620, 2017.
NEIJAT, M. e colab. Hempseed Products Fed to Hens Effectively Increased n-3 Polyunsaturated Fatty Acids in Total Lipids, Triacylglycerol and Phospholipid of Egg Yolk. Lipids, v. 51, n. 5, p. 601–614, 2016.
Nissen, Lorenzo, Emanuele di Carlo, and Andrea Gianotti. “Prebiotic potential of hemp blended drinks fermented by probiotics.” Food Research International 131 (2020): 109029.
ONDREJ, Stastnik e colab. The Effect of Hempseed Cakes on Broiler Chickens Peroformance Parameters. MendelNet, p. 157–160, 2015.
Pojić, Milica, et al. “Characterization of byproducts originating from hemp oil processing.” Journal of Agricultural and Food Chemistry 62.51 (2014): 12436-12442.
Pojić, Milica, et al. “Bread supplementation with hemp seed cake: A by‐product of hemp oil processing.” Journal of food quality 38.6 (20/15): 431-440.
REGGIANI, Remo e RUSSO, Roberto. Beneficial Effect of Supplementation of Flax and Hemp Seeds in the Diet of Alpine Goats on the Iron Content in Blood. Journal of Scientific Research and Reports, v. 10, n. 2, p. 1–5, 2016.
ROUSSEAUX, Christel e colab. Lactobacillus acidophilus modulates intestinal pain and induces opioid and cannabinoid receptors. Nature Medicine, v. 13, n. 1, p. 35–37, 2007.
Rupasinghe, H P Vasantha et al. “Industrial Hemp (Cannabis sativa subsp. sativa) as an Emerging Source for Value-Added Functional Food Ingredients and Nutraceuticals.” Molecules (Basel, Switzerland) vol. 25,18 4078. 7 Sep. 2020, doi:10.3390/molecules25184078
Russo, Roberto, and Remo Reggiani. “Evaluation of protein concentration, amino acid profile and antinutritional compounds in hempseed meal from dioecious and monoecious varieties.” American Journal of Plant Sciences 6.01 (2015): 14.
RUSSO, Ethan B. Beyond Cannabis: Plants and the Endocannabinoid System. Trends in Pharmacological Sciences, v. 37, n. 7, p. 594–605, 2016. Disponível em: http://dx.doi.org/10.1016/j.tips.2016.04.005.
RUSSO, Roberto. Variability in Antinutritional Compounds in Hempseed Meal of Italian and French Varieties. Plant, v. 1, n. 2, p. 25, 2013.
Santos, D. E. L., Santos, M. S. V., Florêncio, M. N. da S., & Oliveira, J. A. M. de. (2021). Technological patenting prospecting of food products with Cannabis sativa or cannabidiol (CBD) addition. Research, Society and Development, 10(4), e20210413929.
Shen, Peiyi, et al. “Ferreting out the secrets of industrial hemp protein as emerging functional food ingredients.” Trends in Food Science & Technology 112 (2021): 1-15.
Shen, P., Gao, Z., Xu, M., Rao, J., & Chen, B. (2020). Physicochemical and structural properties of proteins extracted from dehulled industrial hempseeds: Role of defatting process and precipitation pH. Food Hydrocolloids, 108, 106065.
Simopoulos, Artemis P. “Fatty acids.” Functional foods. Springer, Boston, MA, 1994. 355-392.
ŠKOPEK, Martin e colab. The effect of cannabidiol (Cbd) on simple and complex reaction times. Trends in Sport Sciences, v. 28, n. 2, p. 147–151, 2021.
SKŘIVAN, Miloš e colab. Effects of dietary hemp seed and flaxseed on growth performance, meat fatty acid compositions, liver tocopherol concentration and bone strength of cockerels. Animals, v. 10, n. 3, p. 1–11, 2020.
THORS, L. e BELGHITI, M. e FOWLER, C. J. Inhibition of fatty acid amide hydrolase by kaempferol and related naturally occurring flavonoids. British Journal of Pharmacology, v. 155, n. 2, p. 244–252, 2008.
VAUGHN, Dana M. e PAULIONIS, Lina J. e KULPA, Justyna E. Randomized, placebocontrolled, 28-day safety and pharmacokinetics evaluation of repeated oral cannabidiol administration in healthy dogs. American Journal of Veterinary Research, v. 82, n. 5, p. 405– 416, 2021.
Volkow, Nora D., and Ruben Baler. “Emergency department visits from edible versus inhalable cannabis.” Annals of internal medicine 170.8 (2019): 569-570.
Vonapartis, Eliana, et al. “Seed composition of ten industrial hemp cultivars approved for production in Canada.” Journal of Food Composition and Analysis 39 (2015): 8-12.
Wang, Qingling, Yan Jin, and Youling L. Xiong. “Heating-aided pH shifting modifies hemp seed protein structure, cross-linking, and emulsifying properties.” Journal of Agricultural and Food Chemistry 66.41 (2018): 10827-10834.
White, Alice E., et al. “Cannabis-infused edible products in colorado: Food safety and public health implications.” American journal of public health 110.6 (2020): 790-795.
WORLD ANTI-DOPING AGENCY. Summary of Major Modifications and Explanatory Notes. 2018 Prohibited list. 2018.
WU, Hui e colab. Macamides and their synthetic analogs: Evaluation of in vitro FAAH inhibition. Bioorganic and Medicinal Chemistry, v. 21, n. 17, p. 5188–5197, 2013. Disponível em: http://dx.doi.org/10.1016/j.bmc.2013.06.034.
YU, Cindy H.J. e RUPASINGHE, H. P.Vasantha. Cannabidiol-based natural health products for companion animals: Recent advances in the management of anxiety, pain, and inflammation. Research in Veterinary Science, v. 140, n. August, p. 38–46, 2021. Disponível em: https://doi.org/10.1016/j.rvsc.2021.08.001.
.
Sobre os autores
https://www.linkedin.com/in/raissasansoni/
https://www.linkedin.com/in/lucas-de-freitas-pedrosa-960a54180/









 Creative Commons Attribution
Creative Commons Attribution